初中化学三题分析
第一题:关于化学反应速率的计算
题目描述: 给定以下化学反应:2H₂ + O₂ → 2H₂O,在25℃下,反应物H₂的初始浓度为0.1 mol/L,氧气O₂的初始浓度为0.05 mol/L。经过10分钟后,测得水的浓度为0.08 mol/L。求该反应的反应速率。

解答:
确定反应速率的定义: 反应速率是指在单位时间内反应物浓度的减少或生成物浓度的增加。
计算生成物水的浓度变化: 初始浓度为0,10分钟后浓度为0.08 mol/L,因此浓度变化Δ[H₂O] 0.08 mol/L。

计算反应时间: 反应时间为10分钟。
计算反应速率: 反应速率v Δ[H₂O] / Δt 0.08 mol/L / 10 min 0.008 mol/(L·min)。
第二题:关于溶液pH值的计算
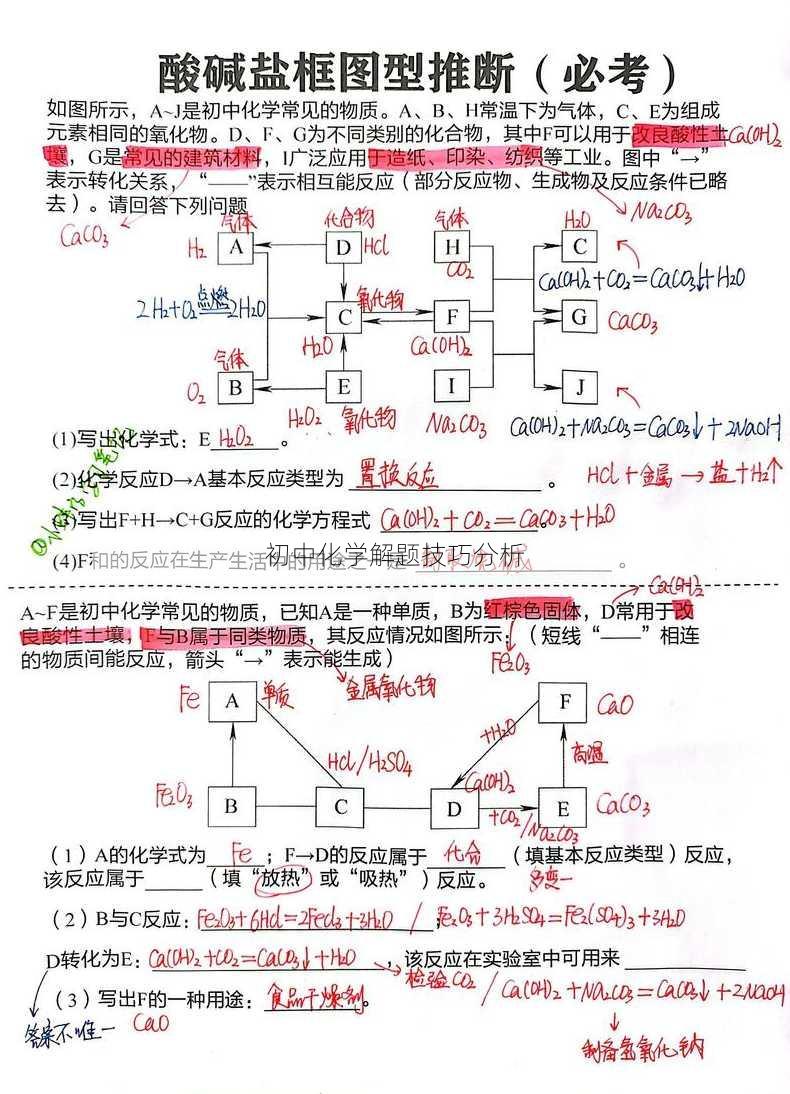
题目描述: 已知某溶液中氢离子浓度为1×10⁻⁵ mol/L,求该溶液的pH值。
解答:
pH值的定义: pH值是溶液中氢离子浓度的负对数,即pH -log[H⁺]。
计算pH值: pH -log(1×10⁻⁵) 5。
第三题:关于电解质溶液中离子浓度的计算
题目描述: 已知某电解质溶液中氯离子Cl⁻的浓度为0.1 mol/L,硫酸根离子SO₄²⁻的浓度为0.05 mol/L,求该溶液中氢离子H⁺的浓度。
解答:
电解质溶液中的电荷平衡: 在电解质溶液中,正负离子的总电荷数必须相等。
电荷平衡方程: 2×[SO₄²⁻] + [Cl⁻] [H⁺]。
代入已知浓度: 2×0.05 mol/L + 0.1 mol/L [H⁺]。
计算氢离子浓度: [H⁺] 0.2 mol/L。
FAQs
- 问:如何计算化学反应速率?
答: 化学反应速率是指在单位时间内反应物浓度的减少或生成物浓度的增加。
- 问:pH值的计算公式是什么?
答: pH值是溶液中氢离子浓度的负对数,即pH -log[H⁺]。
- 问:电解质溶液中电荷平衡的原理是什么?
答: 电解质溶液中正负离子的总电荷数必须相等。
- 问:如何计算电解质溶液中氢离子的浓度?
答: 根据电解质溶液中的电荷平衡方程,通过已知离子的浓度计算氢离子的浓度。
- 问:在化学反应速率的计算中,需要注意哪些因素?
答: 需要注意反应物的浓度、温度、催化剂等因素对反应速率的影响。
